Không lâu sau khi dịch COVID-19 xuất hiện ở Vũ Hán, Trung Quốc, tấn công vào Việt Nam, Bộ Chính trị đã đồng ý chủ trương để Chính phủ chỉ đạo ngành y tế tập trung nghiên cứu, sản xuất vaccine. Đây là giải pháp cơ bản, lâu dài và duy nhất mà các quốc gia đều hướng đến - hoặc bằng nhập khẩu, hoặc bằng tự sản xuất, hoặc cả hai.
Ở Việt Nam, đã có hai nhà sản xuất triển khai trên thực tế: Công ty CP Công nghệ sinh học dược NANOGEN và Viện Vaccine và sinh phẩm y tế IVAC.
Triển khai thử nghiệm lâm sàng giai đoạn 1 từ giữa tháng 12-2020, đến nay vaccine Nano covax của NANOGEN đã bắt đầu thử nghiệm giai đoạn 3 từ ngày 7-6 với khoảng 800 tình nguyện viên, hướng tới quy mô khoảng 13.000 người trên cả nước. Khả năng sản phẩm sẽ ra mắt sớm ba tháng so với kế hoạch ban đầu.
Với IVAC, kết quả nghiên cứu, triển khai vaccine COVID-19 có phần chậm hơn. Covivac, sản phẩm của đơn vị này, được đưa ra thử nghiệm lâm sàng giai đoạn 1 giữa tháng 3-2021 trong phạm vi 120 tình nguyện viên. Đánh giá ban đầu là khá tích cực nhưng cần thêm dữ liệu để theo kế hoạch tiến hành thử nghiệm giai đoạn 2 vào tháng 7 tới.
Hai công nghệ, một mục tiêu
Giải thích sự khác nhau giữa hai vaccine này, GS Trương Việt Dũng, Chủ tịch Hội đồng Đạo đức quốc gia trong nghiên cứu y sinh học - đơn vị tham gia quá trình phê duyệt sản xuất vaccine, cho biết Nano Covax được phát triển trên cơ sở công nghệ vaccine tiểu đơn vị protein, trong đó subunit protein S tái tổ hợp gắn trên giá thể là các hạt nano silica.
Thay vì sử dụng toàn bộ mầm bệnh, vaccine tiểu đơn vị chỉ sử dụng những mảnh kháng nguyên vô hại (protein) của vi sinh vật thích hợp nhất để kích thích tạo đáp ứng miễn dịch phù hợp.
Còn Covivac được sản xuất theo công nghệ kinh điển, sử dụng vector Newcastle trên phôi trứng gà theo dây chuyền sản xuất vaccine cúm mùa.
GS Trương Việt Dũng nói: “Cả hai công nghệ này đều là nhận chuyển giao hoặc hợp tác của nước ngoài. Như Covivac là do đối tác Mỹ ưu tiên chia sẻ công nghệ sản xuất từ khá sớm. Còn Nano Covax là doanh nghiệp cũng mua công nghệ ngoại.
Nhìn chung kết quả thử nghiệm ban đầu của cả hai loại vaccine này đều rất tốt. Hai vaccine phát triển theo hai công nghệ khác nhau nhưng tất cả đều nhằm tạo kháng thể, tác động vào chân bám của virus SARS-CoV-2.
Việc thử nghiệm ở thời điểm Việt Nam xuất hiện biến chủng Anh thì kết quả phân tích cho thấy là có tác dụng phòng ngừa với biến chủng này. Thời điểm đó chưa có biến chủng Ấn Độ nên chưa thể đánh giá hiệu quả được”.
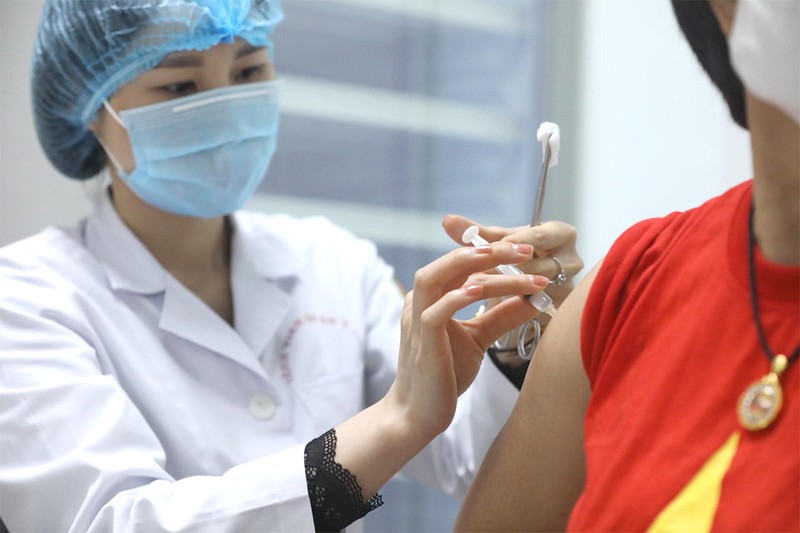
Tình nguyện viên được tiêm thử nghiệm vaccine Nano Covax. Ảnh: VGP
| Hội đồng Đạo đức Quốc gia trong nghiên cứu y sinh học là tổ chức độc lập do Bộ Y tế thành lập, gồm chuyên gia tư vấn xem xét, đánh giá, thẩm định về khía cạnh đạo đức đối với các nghiên cứu y sinh học liên quan đến con người. Liên quan đến việc phát triển vaccine, hội đồng có vai trò phê duyệt đề cương, xem kết quả nghiên cứu vaccine theo đề cương đã phê duyệt. Sau khi hội đồng thông qua, hồ sơ vaccine sẽ trình lên Cục Quản lý dược để xem xét cấp phép đủ điều kiện sản xuất và tiếp đó tới Cục Khoa học Công nghệ và đào tạo xem xét thủ tục cấp phép sản xuất thương mại. |
Nhiều thách thức
Việt Nam nằm trong không nhiều quốc gia chủ động nghiên cứu, sản xuất các loại vaccine. Nhiều loại vaccine nội đã được đưa vào chương trình tiêm chủng quốc gia. tất cả đều theo một quy trình chặt chẽ, thận trọng, với thời gian phát triển cho mỗi loại vaccine có thể tới 7-8 năm.
Nhưng đại dịch COVID-19 không cho phép chờ đợi như vậy.
“Vaccine COVID-19 này làm khó hơn các vaccine khác, vì phải rút ngắn về thời gian. Nghiên cứu, thử nghiệm trong thời gian ngắn nhưng vẫn phải tuân thủ quy trình chung của quốc tế, mà yêu cầu cao nhất là an toàn. Đấy là thách thức lớn nhất” - GS Dũng cho biết.
Theo ông, ngay như Nano Covax của NANOGEN, đã qua hai giai đoạn thử nghiệm với khoảng 1.000 tình nguyện viên, đang triển khai thử nghiệm lâm sàng giai đoạn 3 cho kết quả tích cực, 100% tình nguyện viên sinh miễn dịch, thì cũng chưa kết luận được gì. “Bởi thế giới chưa bao giờ có trường hợp kết luận khi mới thử nghiệm trên một nhóm nhỏ như vậy” - GS Dũng nói.
Thủ tục rút gọn
Việt Nam cho đến nay đã phê duyệt khẩn cấp, có điều kiện một số loại vaccine COVID ngoại như Astra Zeneca (Anh), Sputnik V (Nga), Vero Cell (hãng Sinopharm, Trung Quốc).
Các vaccine này đều được các hãng dược phẩm nước ngoài phát triển trong thời gian rất ngắn so với quy trình thông thường với các loại thuốc, vaccine khác. Điều này cũng được cán bộ của Pfizer tại Việt Nam xác nhận với vaccine chống SARS-CoV-2 của hãng này, vốn đang được đánh giá cao và sử dụng rộng rãi ở nhiều nước trên thế giới.
Câu hỏi đặt ra là liệu Bộ Y tế có phê duyệt theo thủ tục khẩn cấp với Nano Covax hay Covivac - hai vaccine nội địa đang trong quá trình thử nghiệm?
PGS Chử Văn Mến từ Học viện Quân y cho biết khả năng này đang được đặt ra ở giai đoạn 3 thử nghiệm lâm sàng Nano Covax. “Tổng cộng phải qua ba giai đoạn thử nghiệm lâm sàng, trong đó giai đoạn 3 đặt mục tiêu thử với 13.000 tình nguyện viên. Tuy nhiên, nếu cần thiết thì chỉ cần vài ngàn mẫu, cho kết quả tốt thì có thể đề xuất phê duyệt khẩn cấp, đưa vào tiêm đại trà” - ông cho biết.
Còn GS Trương Việt Dũng thì cho rằng trước khi quyết định việc này, Bộ Y tế có thể phải ban hành một thông tư riêng về phê duyệt có điều kiện với vaccine nội.
“Tôi nghĩ, việc này chỉ nên đặt ra khi chúng ta thực sự không tiếp cận được nguồn vaccine có chất lượng từ bên ngoài. Các vaccine ngoại mà Bộ Y tế đã phê duyệt lưu hành trong nước đều đã qua thời gian thử nghiệm, thực chiến kỹ càng. Đây là vấn đề sức khỏe lâu dài, không thể coi nhẹ” - ông Dũng nói.
| Rút gọn hồ sơ mức tối đa cho vaccine về Việt Nam nhanh nhất Liên quan đến việc Cục Quản lý dược công bố danh sách 36 đơn vị đủ thẩm quyền nhập khẩu vaccine, kinh doanh, bảo quản vaccine phòng COVID-19, hiện có những thông tin hiểu chưa đúng về vấn đề này và cho rằng Bộ Y tế có phần ưu tiên các đơn vị này trong nhập khẩu vaccine phòng COVID-19. Để rộng đường dư luận, ông Vũ Tuấn Cường - Cục trưởng Cục Quản lý dược, Bộ Y tế đã có trao đổi với báo chí. Theo ông Cường, hệ thống quản lý vaccine quốc gia của Việt Nam (NRA) được Tổ chức Y tế Thế giới (WHO) đánh giá và công nhận đạt chứng chỉ cấp độ 3. Việc Cục Quản lý dược công khai các đơn vị đạt yêu cầu về nhập khẩu vaccine phòng COVID-19 trên website của cục là theo hướng dẫn của WHO. Liên quan đến việc cấp phép, nhập khẩu vaccine phòng COVID-19, Bộ Y tế đã khuyến khích các địa phương, các tập đoàn, các doanh nghiệp, cá nhân… nếu tiếp cận được vaccine phòng COVID-19 thì bộ sẵn sàng tạo mọi điều kiện hỗ trợ về các thủ tục nhập khẩu. Với các vaccine đã được Tổ chức Y tế Thế giới (WHO) phê duyệt sử dụng trong tình trạng khẩn cấp (từ các cơ sở sản xuất: AstraZeneca, Pfizer, Moderna, Sinopharm, Johnson Với các vaccine đã được các quốc gia khác phê duyệt nhưng chưa được WHO phê duyệt sử dụng trong tình trạng khẩn cấp, Bộ Y tế sẽ xem xét, phê duyệt trong thời gian 10 ngày làm việc khi nhận được đủ hồ sơ hợp pháp, hợp lệ và kèm theo ủy quyền chính thức của cơ sở sản xuất vaccine phòng COVID-19. Trường hợp các doanh nghiệp, tổ chức chưa có kinh nghiệm nhập khẩu vaccine theo quy định, đề nghị liên hệ với các đơn vị đủ điều kiện nhập khẩu vaccine để phối hợp thực hiện hoặc liên hệ với Cục Quản lý dược để được hỗ trợ. Đối với các đơn vị không có khả năng tiêm chủng, Bộ Y tế sẽ chỉ đạo các đơn vị trong ngành y tế tổ chức tiêm chủng cho người dân. Riêng đối với các địa phương, đơn vị có khả năng nhập khẩu, tiếp cận nguồn cung vaccine phòng COVID-19 nêu trên, Bộ Y tế sẽ tạo điều kiện cấp phép nhập khẩu, kiểm định và chỉ đạo tổ chức công tác tiêm chủng đảm bảo tiến độ, an toàn, hiệu quả. “Tuy nhiên, thêm một lần nữa, chúng tôi cũng cảnh báo đến các tổ chức, cá nhân cũng như các địa phương về việc tiếp cận nhập khẩu vaccine phải đảm bảo đúng xuất xứ, nguồn gốc và phải có hồ sơ chất lượng để tránh bị lừa đảo về vaccine” - ông Cường nói. Cục đã làm việc trực tiếp với một số địa phương, trao đổi trên điện thoại với một số địa phương và tập đoàn, doanh nghiệp, đồng thời cũng đã hướng dẫn các thủ tục liên quan đến nhập khẩu vaccine. “Tuy nhiên, đến thời điểm hiện nay, chúng tôi chưa nhận được thông tin về bất kỳ đơn hàng nhập khẩu vaccine phòng COVID-19 nào của các địa phương, tập đoàn, công ty… gửi về Cục Quản lý dược” - ông Cường cho biết. |
